药物临床试验中SAE及SUSAR的上报时限及流程
发布时间:2023-04-22
根据《药物临床试验质量管理规范》、《药物临床试验期间安全性数据快速报告的标准和程序》对于严重不良事件(SAE)和可疑且非预期严重不良反应(SUSAR)的报告要求,对我院SAE及SUSAR的上报时限及流程做如下要求:
一、本中心发生的SAE上报:
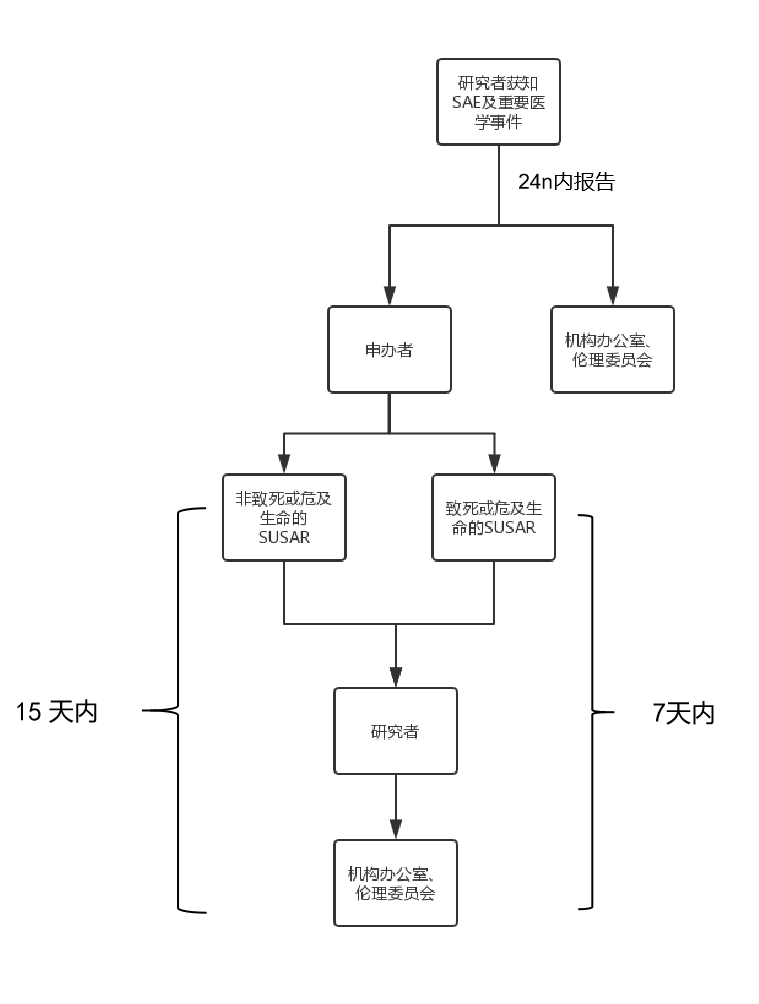
受试者发生严重不良事件及重要医学事件后,研究者应在获知后24h内报告给申办者,同时以书面形式(邮件/纸质文件)报告机构办公室及伦理委员会 。如为邮件形式紧急报告,请在5个工作日内补充递交纸质文件。
二、SUSAR报告
申办者收到任何来源的安全性相关信息后,均应当立即分析评估,包括严重性、与试验药物的相关性以及是否为预期事件等。申办者应当将可疑且非预期严重不良反应快速报告给所有参加临床试验的研究者及临床试验机构、伦理委员会。
(1)致死或危及生命的非预期严重不良反应,申办者在首次获知后7天内以书面形式上报研究者、机构办公室、伦理委员会(以下称“本中心各方”),并在随后的8天内报告、完善随访信息。
(2)非致死或危及生命的非预期严重不良反应,申办者在首次获知后15天内以书面形式报告本中心各方。
(3)申办者在首次报告后,应继续跟踪严重不良反应,获得新信息起15天内以书面随访报告的形式及时报送有关新信息或对前次报告的更改信息等,上报本中心各方。
(4)申办者和研究者在不良事件与药物因果关系判断中不能达成一致时,其中任一方判断不能排除与试验药物相关的,也应该进行按(2)及(3)规定快速报告。
(5)机构安全性报告接收邮箱:shulan-susar@shulan.com
伦理委员会邮箱:yljdllss@shulan.com
邮件命名:本中心机构/伦理受理号-申办者-本院/外院-SAE/SUSAR
二、 DSUR报告及外院SAE报告(如适用)
(1)DSUR报告:申办者以年度为周期递交至本中心各方。
(2)外院SAE报告:申办者每月汇总后以书面形式报告至本中心各方。
SAE及SUSAR上报流程示意图
注1:重要医学事件:必须运用医学和科学的判断决定是否对其他的情况加速报告,如重要医学事件可能不会立即危及生命、死亡或住院,但如需要采取医学措施来预防如上情形之一的发生,也通常被视为是严重的。例如在急诊室的重要治疗或在家发生的过敏性支气管痉挛,未住院的恶液质或惊厥,产生药物依赖或成瘾等。
注2:严重不良反应指以下情形之一:(1)导致死亡;(2)危及生命,指严重病人即刻存在死亡的风险,并非是指假设将来发展严重时可能出现死亡;(3)导致住院或住院时间延长;(4)永久或显著的功能丧失;(5)致畸、致出生缺陷;(6)其他重要医学事件。
注3:非预期不良反应指不良反应的性质、严重程度、后果或频率,不同于试验药物当前相关资料(如研究者手册等文件)所描述的预期风险。研究者手册作为主要文件提供用以判断某不良反应是否预期或非预期的安全性参考信息。如:(1)急性肾衰在研究者手册中列为不良反应,但试验过程中出现间质性肾炎,即应判断为非预期不良反应,(2)肝炎在研究者手册中列为不良反应,但试验过程中发生急性重型肝炎,即应判断为非预期不良反应。
注4:申办者获知的当天为第0天。
注5:机构办公室接受SAE及SUSAR的备案,联系人:金亭含/0571-56098617;
向伦理办公室上报SAE及SUSAR后,定期领取审查决定报告,联系人:管文花/0571-56131318。



