伦理审查委员会伦理审查申请和报告指南
发布时间:2022-11-01
伦理审查委员会伦理审查申请和报告指南
(版本号:2.0;版本日期:2022-08-03)
具体内容
1 伦理联系方式
1.1 伦理微信号:c505074744
1.2 伦理邮箱:yljdll@shulan.com SAE/SUSAR/妊娠报告专用邮箱:yljdllss@shulan.com
1.3 伦理办公室电话:0571-56131318
1.4 伦理办公室地址:杭州市拱墅区东新路848号,
树兰(杭州)医院1号楼门诊3楼03-057房间
2 伦理咨询接待相关事项
2.1 电话咨询或者办公室接待:工作时间周一至周五(双休日、节假日休息),
上午8:00--11:30,下午13:30--17:00。
3 伦理会议及相关工作安排日程
3.1 本院伦理审查委员会的伦理评审会议频率为:一个月2次(特殊情况根据项目数量调整会议频率);会议时间一般固定为:每月第二周和第四周周三(具体时间见伦理审查会议时间安排表,根据实际需要进行临时调整)。
3.2 伦理办公室周四、周五接受纸质资料递交。
4 伦理审查缴费相关事宜
4.1 收费标准
4.1.1 会议审查,为人民币伍仟元(¥5,000)【另加税费336元(6.72%)】,即5336元/每项。
4.1.2 快速审查,为人民币伍佰元(¥500)【另加税费33.6元(6.72%)】,即533.6元/每项。
4.1.3 持续审查,会议审查为人民币贰仟元(¥2,000)【另加税费134.4元(6.72%)】,即2134.4元/每项;快速审查,为人民币伍佰元(¥500)【另加税费33.6元(6.72%)】,即533.6元/每项。
4.1.4 体外诊断试剂审查,初始审查5个试剂以内为人民币叁仟元(¥3,000)【另加税费201.6元(6.72%)】,即3201.6元,超过1个增加1000元(税费同上)。
4.1.5 加快审查(仅限新型冠状病毒项目),为人民币捌仟元(¥8,000)【另加税费537.6元(6.72%)】,即8537.6元/每项;快速审查,为人民币伍佰元(¥800)【另加税费53.76元(6.72%)】,即853.76元/每项。
4.2 汇款账户
4.2.1 请及时缴纳伦理评审费用,缴费账号户名:树兰(杭州)医院有限公司;
开户银行:中信银行钱江支行;
帐号:8110801014900057002。
汇款时请注明:项目伦理受理号+财务号+审查类别+PI。
4.3 缴费及开票时限要求
4.3.1 形式审查完成后,请完成缴费并提供银行付款凭证和伦理交费通知函。
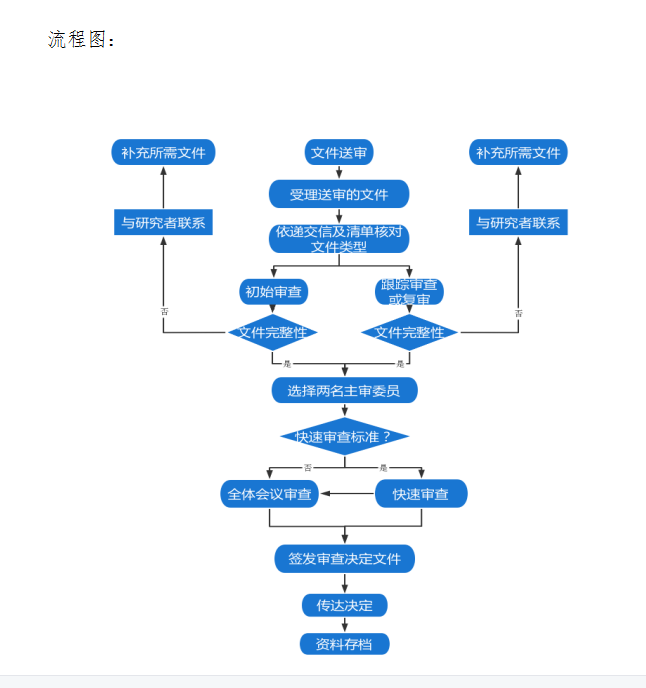
5 新项目会议审查流程
5.1 机构登记流程
5.1.1 按照机构流程,获得《临床研究初审通知书》。
5.2 预审、形式审查与项目受理
5.2.1 经机构办公室审核之后,发送《临床研究初审通知书》及伦理审查相关材料的电子版本至伦理邮箱(yljdll@shulan.com)进行预审(如CTMS系统启用, 登陆我院CTMS系统按照伦理审查送审文件清单递交相关资料);(详见伦理送审文件清单;填写初始审查申请)。
5.2.2 电子材料审核通过后,携带上会资料纸质版完整版1 份,纸质版的PDF版同时发至伦理邮箱(如CTMS系统启用,可上传系统)。
5.2.3 形式审查:形式审查确认通过后,纸质版与电子版一 致,当场受理资料,安排上会。伦理秘书在会前通知研究者答辩顺序及答辩时间、地点。
5.3 纸质资料要求
5.3.1 完整版纸质材料1份,盖章要求同机构。
5.3.2 初始审查为会议审查项目须递交试验方案、知情同意 书、招募材料18份(要求纸质盖章版的复印件,作为会议审查简版资料)。
5.3.3 纸质资料装订顺序与电子版顺序一致。
5.3.4 纸质装订要求:资料需要打孔用黑色文件夹装订,各 个文件中间要有隔页隔开,资料需要申办者或申办者委托方盖章,2页及以上资料需要正面盖章和齐缝章。
5.3.5 准备蓝色资料盒1个(规格要求:A4 238x320x55mm),侧页均须按模板要求。

5.4电子资料要求:签字盖章纸质版的PDF扫描版本(如与纸质版存在不一致,请自行承担责任)
5.5 确认答辩研究者与答辩PPT,PPT要求请参照“汇报PPT注意事项”;递交伦理跟踪审查的各类申请。
5.6 缴费要求:按照我院收费标准,完成付款后将汇款凭证及伦理缴费通知函发送至伦理邮箱,特殊开票要求请在伦理缴费通知函中注明;收到以上资料我院财务科予进行开票,开票时间一般为每月底一次,发票在合同签署后开具,到伦理办公室领取。
5.7 伦理会议审查
5.7.1 一般情况下,每月第二周和第四周周三为伦理委员会 会议审查日期(特殊情况根据项目数量调整会议频率),详见官网通知。
5.7.2 汇报要求:1)初始审查,主要介绍方案和知情同意书;5-10min; 2)修正案审查,介绍项目进展情况、修正内容;5-10min;3)持续审查,介绍项目进展情况,包括受试者入选情况、SAE/SUSAR、PD/PV等;5min之内。
5.8 意见反馈与交流
5.8.1 审查决定文件传达:会议审查在伦理审查会议后7个工作日;快速审查,受理后7个工作日;须凭付款凭证获取伦理审查决定文件。
6 项目跟踪审查
6.1 修正案审查
6.1.1 在试验实施过程中,对研究方案和知情同意书等相关 文件所作的任何修改,均需得到伦理委员会审查同意后方实 施。研究者须填写“修正案审查申请”及相关资料,根据修
改内容是否重大,是否影响受试者的风险/受益,递交会议
审查或快速审查,审查资料见修正案审查清单。
6.2 持续审查
6.2.1 根据项目的持续审查频率,请在持续审查到期前1个月递交“研究进展报告”及相关资料,持续审查的审查方式为会议审查或快速审查,审查资料见持续审查清单。
6.3 安全性信息报告
6.3.1 若试验过程中发生严重不良事件、非预期严重不良事件、可能影响风险收益比的任何事件和新信息须及时报告本院伦理委员会。本院发生的SAE,研究者仍需24小时内上报,将填写完整的PDF版发送到伦理邮箱yljdllss@shulan.com,纸质版PI签字后递交到伦理办公室;临床试验过程中发生可疑且非预期严重不良反应,对于致死或危及生命的非预期严重不良反应,申办者应在首次获知后尽快报告,但不得超过 7 天,并在随后的8天内报告、完善随访信息;对于非致死或危及生命的非预期严重不良反应,申办者应在首次获知后尽快报告,但不得超过 15 天。
6.3.2 外院SUSAR发送到伦理邮yljdllss@shulan.com每3个月汇总后将列表与个案递交到伦理办公室。
6.4 违背方案报告
6.4.1 若试验过程中发生违背方案,申办者和/或研究者应就事件的原因、影响及处理措施予以说明,并报告伦理委员会;可参照我院“违背方案报告”模板报告。
6.4.2 重大违背方案情况获知后及时上报到伦理办公室(一般要求一周内);其他违背方案情况可一个月内上报一次。
6.5 暂停/终止研究报告
6.5.1 若暂停或提前终止试验项目,应填写“暂停/终止研究报告”(报告表),连同项目终止函一并报告本院伦理委员会。
6.6项目结题
6.6.1 临床试验结束后,须向本院伦理委员会递交“结题报告”及相关资料,审查资料见结题审查清单,并于接待日进行资料整理归档。
7 复审
7.1 若有审查意见,须根据审查意见进行补充或修正,并递交复审申请及相关资料,“修改后同意”进入加快审查程序;“不同意”,再次申请进入会议审查程序,审查资料见复审清单。